Legge delle proporzioni multiple
La legge delle proporzioni multiple è una legge fondamentale della chimica, in base alla quale quando due elementi reagenti possono combinarsi per formare più composti, una stessa quantità di massa di un elemento si combina con quantità multiple dell'altro e i rapporti multipli tra gli elementi sono espressi da numeri interi.
La legge delle proporzioni multiple viene scoperta dallo scienziato John Dalton alla fine del XVIII secolo. Dalton amplia la legge delle proporzioni definite già formulata da Proust, osservando in natura l'esistenza dei rapporti multipli costanti.
Un esempio pratico
Ad esempio, il carbonio e l'ossigeno possono combinarsi tra loro per formare l'ossido di carbonio ( CO ) oppure l'anidride carbonica ( CO2 ).
Nel caso dell'ossido di carbonio il rapporto di combinazione della massa tra carbonio e ossigeno è pari a 12/16. In altri termini, 12 grammi di carbonio reagiscono con 16 grammi di ossigeno creando la molecola dell'ossido di carbonio ( CO ).
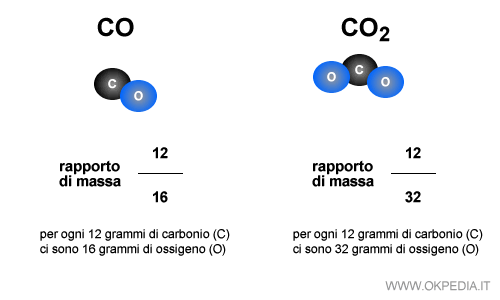
Nel caso dell'anidride carbonica ( CO2 ) la massa del carbonio è uguale ( 12 grammi ) mentre la massa dell'ossigeno raddoppia ( 32 grammi ) in quanto la molecola contiene due atomi di ossigeno e un atomo di carbonio e il rapporto di combinazione della massa passa da 12/16 a 12/32.
In generale, quando due elementi possono combinarsi e dare origine a più composti, la stessa massa di un elemento e le varie quantità di massa dell'altro elemento si combinano secondo dei rapporti multipli interi.
Lo stesso fenomeno si verifica nei composti chimici dell'azoto e dell'ossigeno. L'azoto e l'ossigeno possono reagire dando vita a diversi composti ( NO, N2O, N2O3, ecc. ). Il rapporto tra azoto (N) e ossigeno (O) è 7/8. Quindi nel composto NO il rapporto di combinazione della massa tra azoto e ossigeno è pari a 7/8.
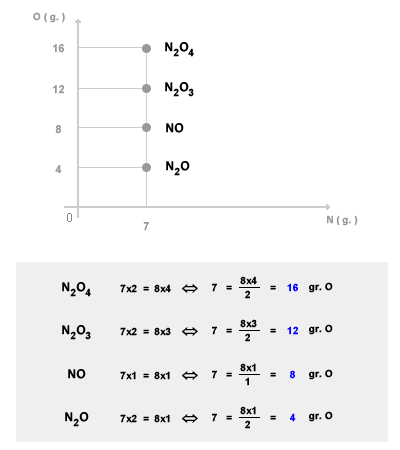
Mantenendo costante la massa dell'azoto (N) a 7 grammi, nel caso del composto N2O il rapporto di combinazione della massa è pari a 7/4. Nel composto N2O3 il rapporto è pari a 7/12. Nel composto N2O4 il rapporto è 7/16. Ecc. Come si può notare il rapporto di combinazione della massa nei vari composti si modifica seguendo un rapporto multiplo.
Dalton deduce l'esistenza degli atomi. Dall'osservazione delle proporzioni multiple degli elementi chimici Dalton deduce anche l'esistenza degli atomi. Si accorge che gli elementi chimici si combinano tra loro secondo un rapporto di massa composto da numeri interi. Pertanto, deduce l'esistenza di unità indivisibili per ciascun elemento chimico.
