Legge delle proporzioni definite
La legge delle proporzioni definite è una legge chimica, in base alla quale in una reazione chimica due o più elementi reagenti si combinano tra loro per dare luogo a un composto ( prodotto ) secondo un determinato e costante rapporto di combinazione di massa. La legge delle proporzione definita viene scoperta per la prima volta dallo scienziato francese Joseph-Louis Proust nel 1799. La combinazione degli atomi di un composto si verifica sempre secondo un rapporto costante. Ogni composto è caratterizzato da un rapporto fisso caratteristico degli elementi che lo compongono. Ad esempio, due atomi di idrogeno (H) e un atomo di ossigeno (O) reagiscono tra loro per formare una molecola d'acqua (H2O). L'atomo di ossigeno ha una massa sedici volte superiore rispetto alla massa di un atomo di idrogeno.
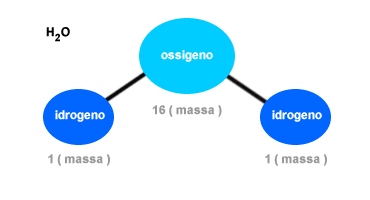
Il rapporto di combinazione di massa dell'acqua è, quindi, pari a 2 grammi di idrogeno (H) ogni 16 grammi di ossigeno (O). È possibile scrivere il rapporto di combinazione di massa tra idrogeno e ossigeno in una molecola d'acqua ( composto ) pari a 2/16 o, più semplicemente, a 1/8. Tale rapporto è costante indipendentemente dalla quantità di atomi di idrogeno e di ossigeno.

La massa eccedente alla proporzione definita non reagisce con l'altro elemento. Ad esempio, 2 grammi di idrogeno e 10 grammi di ossigeno reagiscono tra loro formando 9 grammi di acqua ( 1 grammo di idrogeno e 8 grammi di ossigeno ). I restanti grammi di idrogeno ( 1 grammo eccedente ) e di ossigeno ( 2 grammi eccedenti ) non reagiscono tra loro e restano immutati.
