Legami a idrogeno
I legami a idrogeno sono legami che si formano tra le molecole d'acqua La regione polare con carica negativa della molecola instaura un legame con la regione polare con carica opposta ( positiva ) di un'altra molecola. Ogni molecola d'acqua può instaurare fino a quattro legami a idrogeno con altre molecole d'acqua o molecole idrofile. Il legame a idrogeno è temporaneo e dura poche frazioni di secondo. Dopo essersi spezzato tende a riformarsi subito dopo con la stessa molecola oppure con molecole diverse. La tensione superficiale determina l'attrazione ( coesione ) tra le molecole d'acqua.
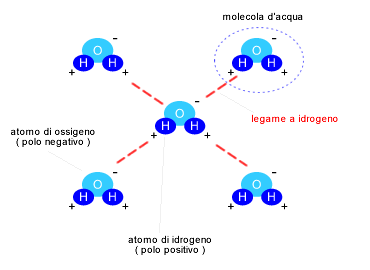
Allo stato liquido una molecola d'acqua tende a formare meno di quattro legami contemporanei con le altre molecole d'acqua Al diminuire della temperatura, durante il processo di solidificazione ( congelamento ) dell'acqua, le molecole tendono a formare quattro legami con altrettante molecole e la durata di ogni singolo legame aumenta. Allo stato solido ( ghiaccio ) il legame a idrogeno tra le molecole è permanente. Questo conferisce solidità al ghiaccio. Viceversa, allo stato gassoso ( evaporazione ), il legame a idrogeno tra le molecole è minimo e le molecole d'acqua, libere dai legami e cariche di energia termica, si muovono velocemente nell'aria.
